HINWEIS!
Die Zeichnung dient dir als Hilfe, um deine Vorstellungen zu aktivieren. Sie kann nicht falsch oder richtig sein!
Bitte gehe deshalb nicht zurück und verändere deine Zeichnung, wenn du nun die Simulation siehst!
Aufgabe 1:
Beobachte wie sich das Chemische Gleichgewicht zwischen Stickstoffdioxid und Distickstofftetraoxid ausgehend von unterschiedlichen Startbedingungen bei Raumtemperatur einstellt. Hinweis: Die Simulation stoppt automatisch.
Aufgabe 1:
Beobachte wie sich das Chemische Gleichgewicht zwischen Stickstoffdioxid und Distickstofftetraoxid ausgehend von unterschiedlichen Startbedingungen bei Raumtemperatur einstellt. Hinweis: Die Simulation stoppt automatisch.
Erkläre, warum sich die Konzentrationen im Gleichgewichtszustand nicht mehr ändern:
Aufgabe:
Sieh dir deine anfänglichen Zeichnungen nochmal an. Überlege, welche neuen Inhalte du durch die Simulation gelernt hast. Ergänze deine Zeichnungen oder fertige neue Zeichnungen an. Erläutere anschließend erneut deine Vorstellungen.
1. Gleichgewichtszustand im linken Behälter
2. Gleichgewichtszustand im rechten Behälter
Beschreibe deine Zeichnungen und erläutere deine Vorstellungen erneut:
Ein geschlossener Behälter ist bei Raumtemperatur zu Beginn mit gasförmigem Wasserstoff und gasförmigem Iod (100 %) gefüllt. Die beiden Stoffe reagieren zu Iodwasserstoff (siehe Gleichung unten). Zeitgleich zerfällt ein Teil des Iodwasserstoffs wieder zurück in die beiden Edukte. Die Geschwindigkeitskonstante der Rückreaktion (Zerfall) ist etwas kleiner, d.h. die Rückreaktion ist prinzipiell etwas langsamer als die Hinreaktion (Bildung). Nach einiger Zeit stellt sich ein Zustand ein, in dem sich die Konzentrationen der Edukte und Produkte nicht mehr ändern.

Aufgabe:
Betrachte die abgebildeten Konzentrations-Zeit-Diagramme zum beschriebenen Gleichgewicht. Wähle das Diagramm aus, das die Entstehung und den Zustand im Gleichgewicht deiner Meinung nach abbildet und begründe deine Wahl im vorgesehenen Feld.
Begründe deine Wahl:
Bitte überprüfe deine Eingaben und versende die Datei durch den Button am Ende der Seite
Feld 1: Geschlecht (w) für weiblich / (m) für männlich / (d) für divers
Feld 2: Der 2. und 3. Buchstabe deines Nachnamens (z.B. EY bei Meyer)
Feld 3: Der Tag deines Geburtstags in Zahlen (z.B. 24 oder 02)
Feld 4: Der jeweils 1. Buchstabe des Vornamens deiner Mutter und deines Vaters (z.B. LA bei Lea und Anton)
Stickoxid ist ein Sammelbegriff für unterschiedliche Oxide des Stickstoffs (wie bspw. NO, NO2 oder N2O4). Alle Formen wirken reizend und schädigend auf die Atemorgane. Insbesondere Autoabgase tragen zu großen Teilen zur Belastung bei.
Stickstoffmonoxid entsteht als erstes Produkt der Verbrennungsreaktion in Otto- und Dieselmotoren. Für die Verbrennung des Kraftstoffs wird Luft aus der Umgebung angesaugt und beides zusammen verbrannt. Üblicherweise bildet sich aus den in der Luft enthaltenen Gasen Sauerstoff und Stickstoff kein Stickstoffmonoxid aufgrund der extrem hohen Aktivierungsenergie (vgl. Abbildung rechts). Die auftretenden Temperaturen im Motor von bis zu 2000°C ermöglichen jedoch die Bildung der endothermen Verbindung. Üblicherweise zerfallen solche Verbindungen wieder, wenn die Temperatur absinkt. Die Aktivierungsenergie für die Rückreaktion ist jedoch so hoch, dass diese nur abläuft, wenn die Abgase auf dem Weg zum Auspuff langsam abgekühlt werden. Dies passiert nur zu geringen Teilen, weshalb Abgaskatalysatoren eingesetzt werden müssen.


Abgaskatalysatoren werden eingesetzt, um die Umweltbelastung durch Stickoxide von Automobilen zu reduzieren.
Aufgabe:
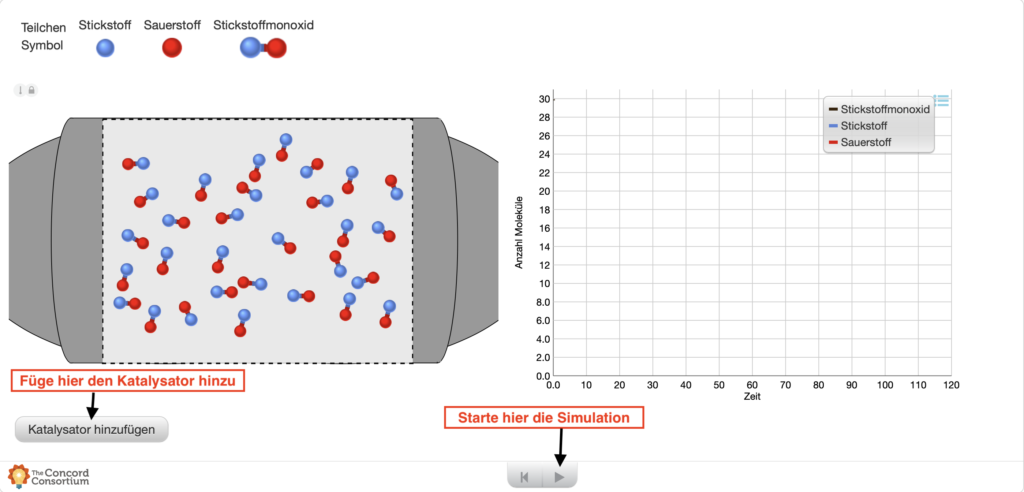
Sieh dir den Verlauf der Reaktion von Stickstoffmonoxid zu Sauerstoff (rote Teilchen) und Stickstoff (blaue Teilchen) an und stelle dir vor, was genau der Katalysator (graue Teilchen) mit den Teilchen während der Reaktion macht. Zeichne und erläutere deine Vorstellung in den vorgesehenen Feldern.
Vor der Reaktion
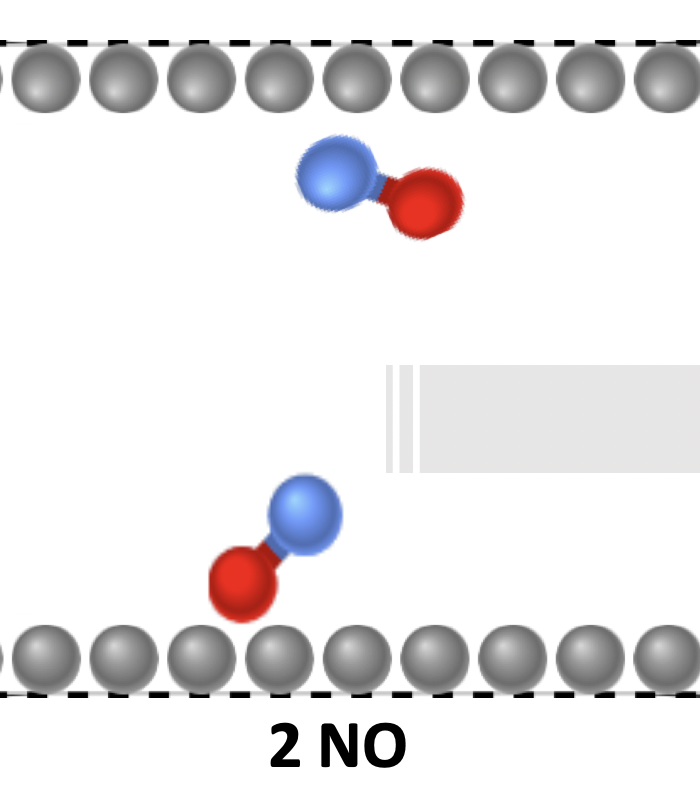
1. Zeichne selbst: Während der Reaktion
Nach der Reaktion
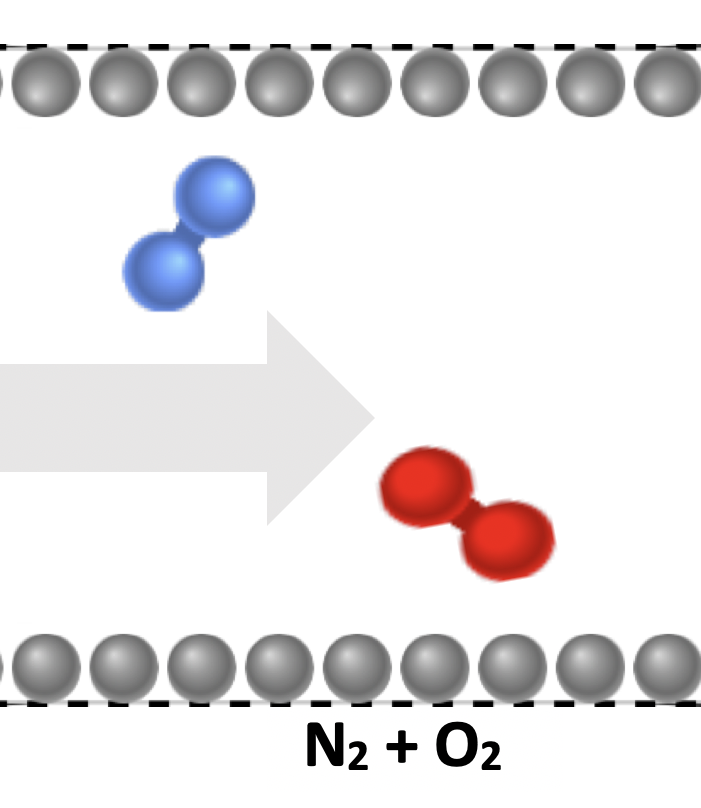
2. Beschreibe deine Zeichnung und erläutere deine Vorstellung:
Aufgabe 1:
Beobachte den Zerfall von Stickstoffmonoxid mit und ohne Katalysator.