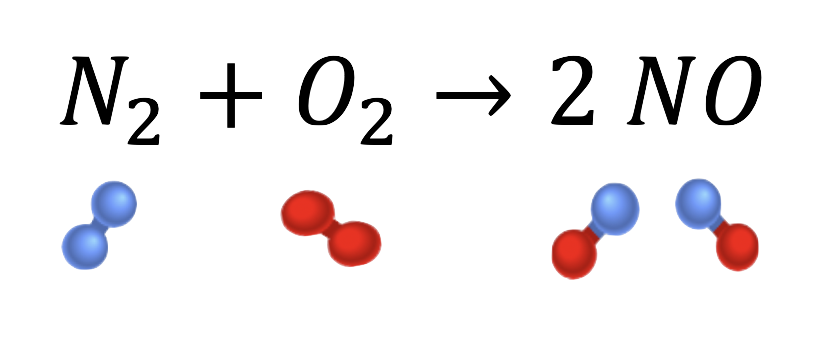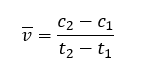Dünger aus der Luft – Das historische Birkeland-Eyde-Verfahren
Um in der Landwirtschaft genügend Pflanzen als Nahrungsquelle wachsen zu lassen, wird Stickstoff (N2) als Dünger benötigt. Zwar besteht die Luft zu 78 % aus diesem, für Pflanzen ist er aber nur als Verbindung mit anderen Atomen nutzbar. Es müssen deshalb effiziente Methoden gefunden werden, um den Stickstoff aus der Luft in für die Pflanzen aufnehmbare Verbindungen umwandeln zu können. Diese Methoden werden als „Fixierung“ des Luftstickstoffs bezeichnet.
Ein Beispiel für die Fixierung von Luftstickstoff ist ein Verfahren, das 1903 von den beiden Norwegern Birkeland und Eyde entwickelt wurde. Beim Birkeland-Eyde-Verfahren wird zwischen zwei Elektroden ein Blitz erzeugt, der in ein Gemisch aus Sauerstoff (O2) und Stickstoff (N2) geleitet wird. Es entsteht Stickstoffmonoxid (NO):
N2 + O2 → 2 NO
Dieses kann als Ausgangsstoff für die Düngerherstellung dann weiter zu Nitrat-Salzen (NO3–) reagieren.
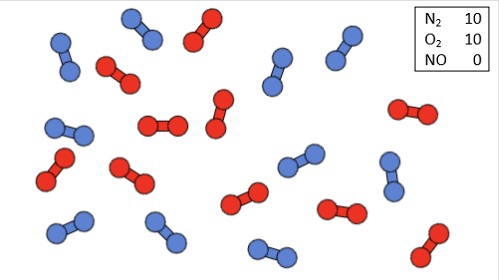
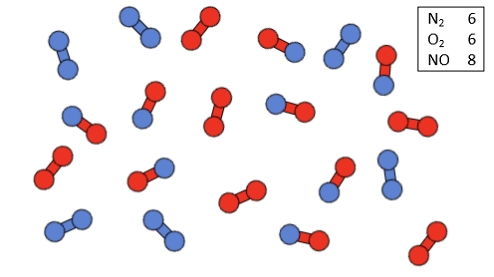
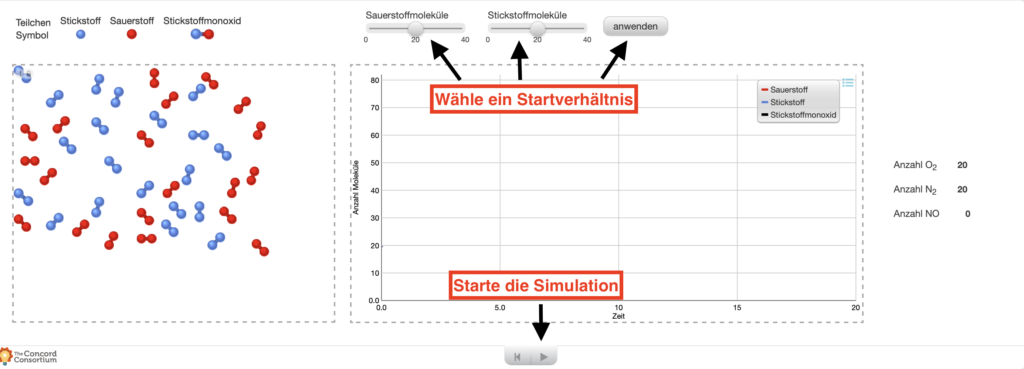
Die wichtige Reaktion wird auch im Labor untersucht, um sie besser zu verstehen. Besonders die Reaktionsgeschwindigkeit ist dabei interessant. Da aus Sicherheitsgründen im Labor gerne mit geringeren Konzentrationen gearbeitet wird, stellt sich beispielsweise folgende Frage:
Welchen Einfluss hat eine Halbierung der Eduktkonzentrationen auf die Reaktionsgeschwindigkeit?