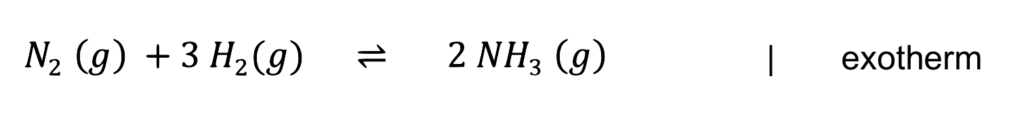Phase 1: Zeichnung
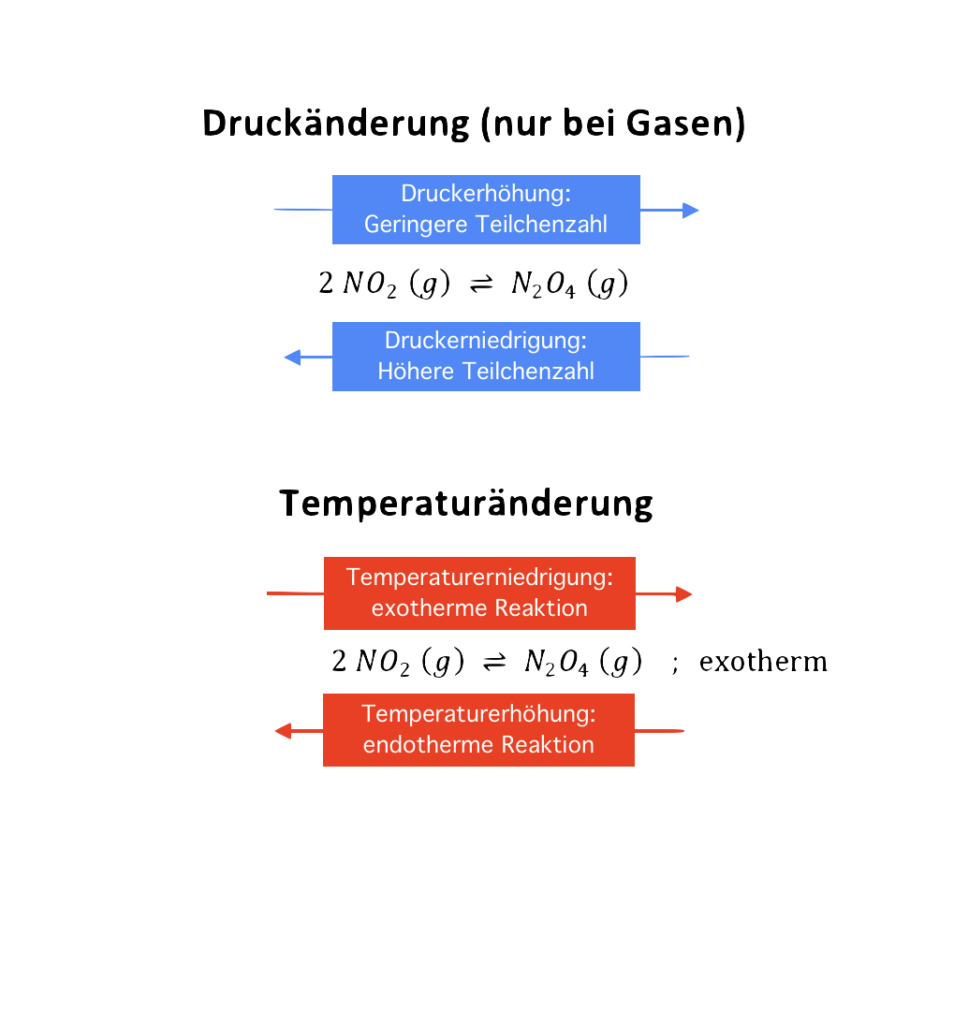
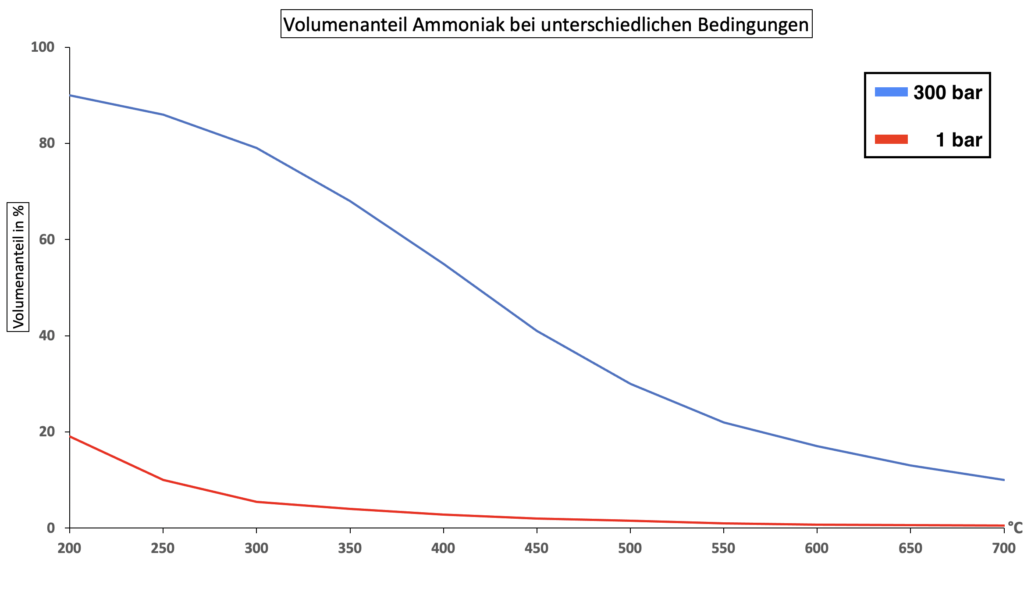
Die Reaktion von Stickstoffdioxid (NO2) zu Distickstofftetraoxid (N2O4) verläuft exotherm:
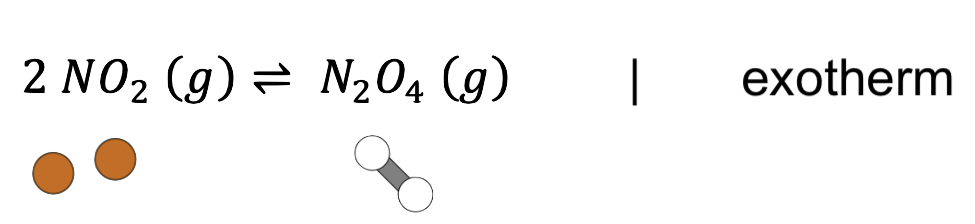
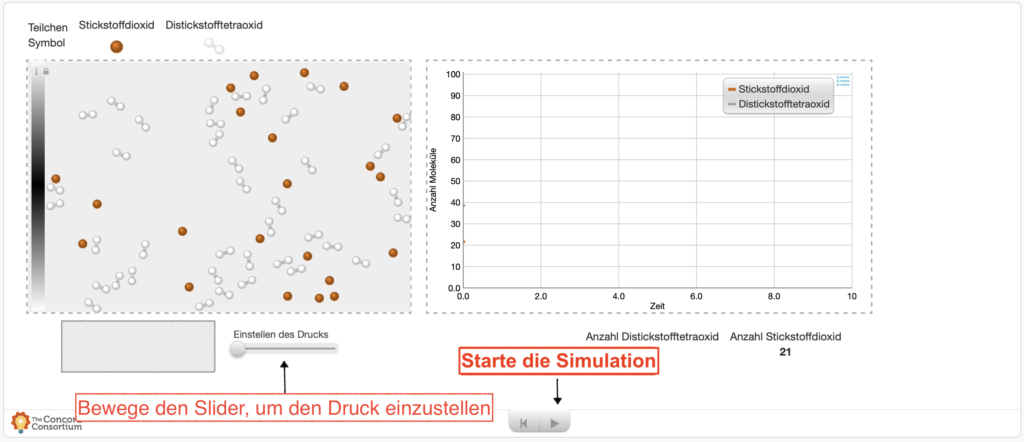
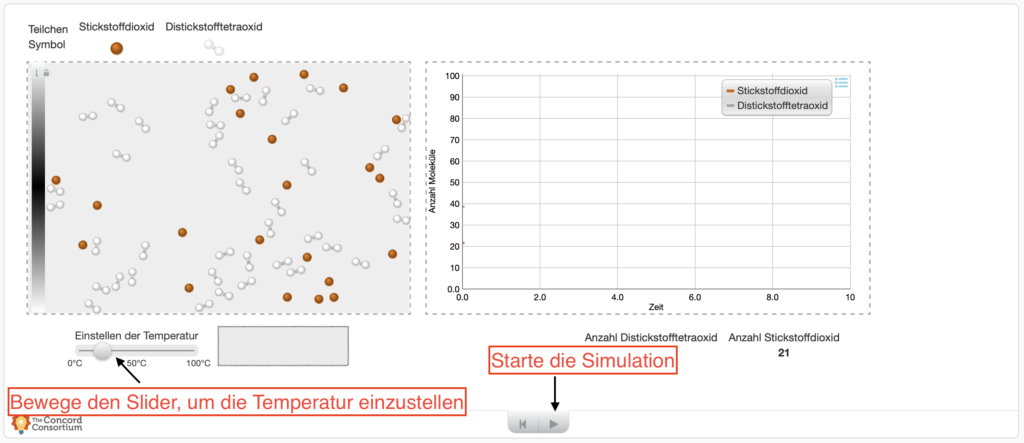
Sieh dir den anfänglichen Zustand im Gleichgewicht zwischen den beiden Stoffen an:
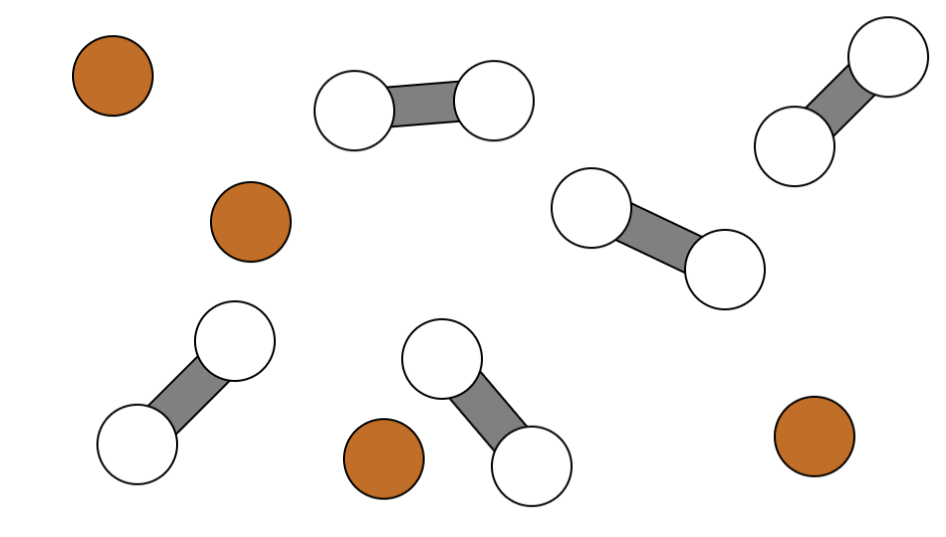
Aufgabe:
Zeichne den Gleichgewichtszustand (GGZ) nach einer Erhöhung des Drucks links bzw. nach einer Erhöhung der Temperatur rechts und erläutere deine Vorstellungen in den vorgesehenen Feldern.
GGZ nach Erhöhung des Drucks (Temperatur bleibt konstant)
GGZ nach Erhöhung der Temperatur (Druck bleibt konstant)
Beschreibe deine Zeichnungen und erläutere deine Vorstellungen