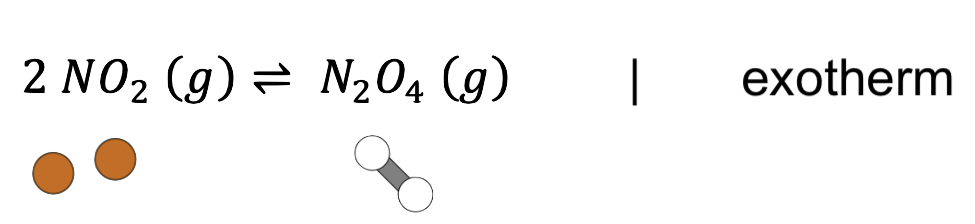Stickoxidabgase im Gleichgewicht
Im Jahr 2015 wurde Deutschland aufgrund hoher Stickoxid-Werte von der EU verklagt. Die Anzahl der Überschreitungen des EU-Grenzwerts ist seitdem rückläufig, trotzdem überschritten 2019 noch 20 % aller gemessenen Städte den Wert von 40 Mikrogramm pro Kubikmeter.
Stickoxide, wie bspw. NO, NO2 oder N2O4 wirken auf den Menschen giftig. Hauptquelle sind Automotoren im Straßenverkehr. Beim Austritt aus dem Auspuff bildet sich aus Stickstoffmonoxid (NO) zusammen mit Sauerstoff aus der Luft Stickstoffdioxid (NO2).
Stickstoffdioxid gilt als Indikator für die Luftqualität. Unerwähnt bleibt dabei häufig, dass sich dieses braune Gas in der Atemluft in einem chemischen Gleichgewicht mit dem farblosen Gas Distickstofftetraoxid (N2O4) befindet (vgl. Gleichung unten).
Das entstehende Gleichgewicht erschwert die Bestimmung der tatsächlichen Stickstoffdioxidbelastung in der Umgebungsluft zur Beurteilung von Grenzwerten, weil das entstehende NO2 teilweise zu N2O4 weiterreagiert.