Phase 4: Anwendung
Ammoniak (NH3) ist Ausgangsstoff für zahlreiche Düngemittel und damit eine der wichtigsten Chemikalien für die Nahrungsmittelproduktion weltweit. Die Synthese erfolgt nach dem Haber-Bosch-Verfahren, bei dem aus dem reaktionsträgen Stickstoff zusammen mit Wasserstoff in einer exothermen Gleichgewichtsreaktion Ammoniak entsteht (s. Gleichung unten).
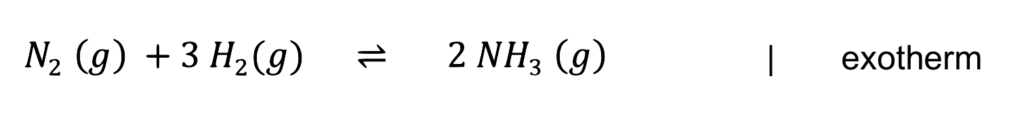
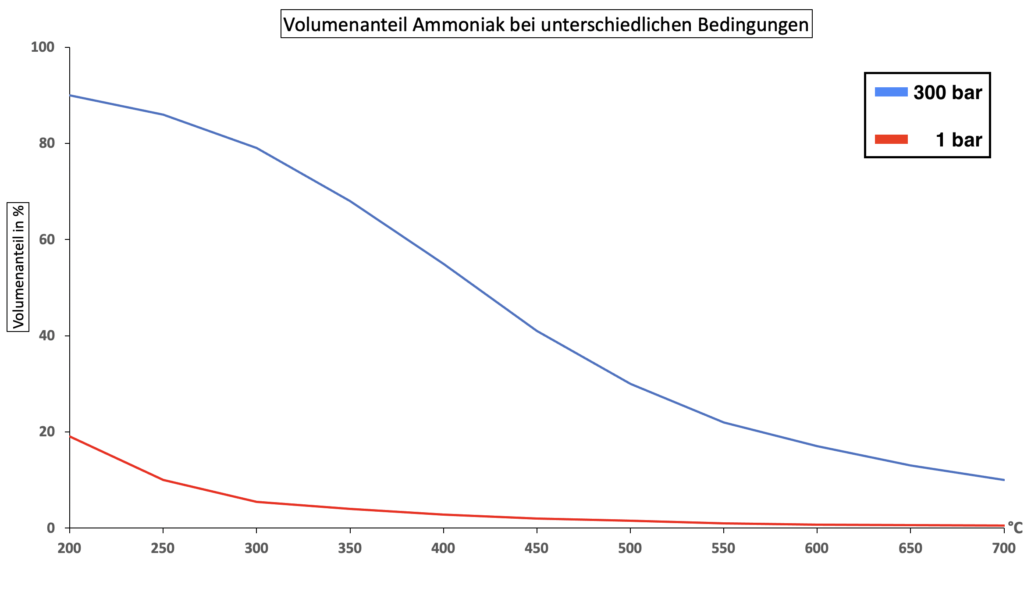
Bei Raumtemperatur ist die Reaktionsgeschwindigkeit der Umsetzung so gering, dass sich das Gleichgewicht erst nach sehr langer Zeit einstellt. Notwendig für die Reaktion ist deshalb ein Katalysator, der ab ungefähr 450 °C aktiv ist. Das Diagramm zeigt dir den so entstehenden Ammoniakanteil im Gleichgewicht bei unterschiedlichen Druck- und Temperaturbedingungen.
Aufgabe:
Erläutere anhand des Diagramms und dem Prinzip von Le Chatelier, warum eine Temperaturerhöhung auf 700 °C zwar die Reaktionsgeschwindigkeit steigern, aber den Umsatz an Ammoniak nicht erhöhen würde, sondern dies einer Druckerhöhung bedarf.
Erläutere hier: